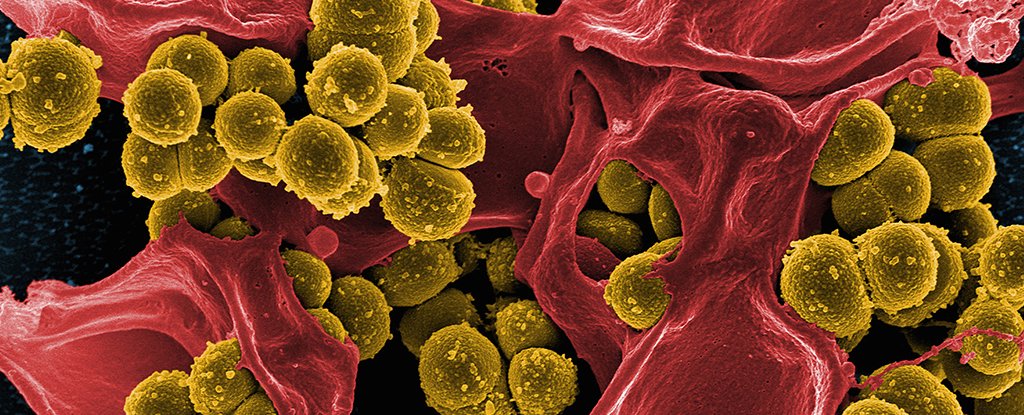
Das Auffüllen von Keimtaschen mit Gold kann eine einfache Möglichkeit sein, eine Infektion zu beenden. Frustrierenderweise haben sich Wissenschaftler schwer getan, diese Masse an Wissen in eine praktische antimikrobielle Behandlung umzuwandeln.
Forscher der Southern University of Science and Technology, der Fudan University in China und der University of Leeds in Großbritannien haben sich kürzlich zusammengetan, um Gold-Nanocluster wieder zusammenzusetzen, um sie für Bakterien attraktiver und für unseren Körper weniger schädlich zu machen.
Durch das Verweben von Gold in zwei Partikel mit kontrastierenden elektrostatischen Adhäsionswerten baute das Team ein Partikel, das die Fähigkeit besitzt, Löcher in die Abwehr vieler gängiger bakterieller Krankheitserreger zu schlagen, ohne sich an umliegendem Gewebe anzuheften.
Auf den ersten Blick mag Gold nicht wie ein offensichtliches keimtötendes Mittel erscheinen. Durch die Zerkleinerung zu einem nanofeinen Staub kann dieses schwere Element schwere Schäden anrichten.
Eine Möglichkeit, wie Goldnanopartikel dies erreichen, besteht darin, chemische Reaktionen zu ermöglichen, die Sauerstoffarten freisetzen, die die DNA schädigen können. Eine andere Möglichkeit besteht darin, in die Zellmembranen einzugreifen und sie für verschiedene toxische Substanzen, wie beispielsweise Antibiotika, durchlässiger zu machen. Sie können auch Absorbiert das Licht des Lasers Mit hoher Effizienz wird die Umgebung erhitzt und geröstet.
Leider unterscheiden diese nützlichen Methoden zur Beseitigung einer Infektion nicht immer die Bakterien vom Wirt, Unsere Zellen gefährden Behandlungen mit Goldnanopartikeln.
Was wir brauchen, ist eine Möglichkeit, Bakterien zu ermutigen, so viel Gold wie möglich zu sammeln, und gleichzeitig sicherzustellen, dass unsere Zellen nicht dasselbe tun.
In den letzten Jahren haben Ingenieure das Verhalten von Gold-Nanopartikeln auf zwei Arten manipuliert.
Die erste besteht darin, seine Größe genau zu kontrollieren. Wenn die Partikel unter 2 Nanometern gehalten werden, können die Partikel besser durch die Nieren gleiten, was zu einem schnelleren Austritt aus unserem Körper führt. Daher konzentrierten sich die Forscher darauf, die Größe ihrer Gruppen auf nur 25 Atome zu begrenzen.
Die zweite ist der Einbau von „klebrigen“ chemischen Strukturen, den sogenannten Bindungen, die ihnen unterschiedliche Eigenschaften verleihen Leicht zu verfolgen oder helfen Kontrolle der Partikelform.
In diesem Fall hofft das Team, dass die negativ geladenen Bakterienzellen durch das Aufbringen eines positiv geladenen Liganden auf die Cluster Gold anziehen wie eine Jacke, die Katzenhaare anzieht.
Eine zusätzliche Optimierung der Partikel, um die Wahrscheinlichkeit zu verringern, dass sie den Körper des Wirts beeinträchtigen, würde einen großen Beitrag dazu leisten, die Goldtherapie in eine klinische Realität zu verwandeln. Aber frühere Studien hatten kein Glück, Gold-Nanopartikel mit etwas mehr als einer Einfachbindung einzufangen, da die Möglichkeiten, Bindungen mit unterschiedlichen Talenten zu kombinieren, in der Regel unvereinbar sind.
Dieses Mal hatte das Team eine Erfolgsformel, basierend auf einer Mischung einer positiv geladenen Verbindung namens Pyridinium und Zwitterion, eine Verbindung mit negativen und positiven Gruppen.
Pyridinium hilft, Gold für Bakterien attraktiver zu machen. Das Zwitterion wurde basierend auf früheren Studien ausgewählt, die eine verbesserte Stabilität und größere Kompatibilität mit tierischen Geweben zeigten.
Auf Methicillin-Resistenz getestet Epidermale Staphylokokken (MRSE) hatten die verbesserten Goldnanocluster einen deutlichen Einfluss auf die Aggregationsfähigkeit von Bakterien. Sie erzeugen auch reaktive Sauerstoffspezies und haben die Integrität ihrer Membranen beeinträchtigt.
Noch besser, bei der Einnahme verschiedener Antibiotika-Dosen nahm die Anzahl der Bakterien ab. In einem Fall wurde die zur Hemmung des MRSE-Wachstums erforderliche Dosis um mehr als das 100-fache verringert.
Tests an Mäusen mit MRSE-Hautinfektionen halfen zu bestätigen, dass die Goldpartikel zur Heilung beigetragen haben, ohne dass sie irritierend wurden.
„Durch die systematische Anpassung des Vernetzungsverhältnisses haben wir einen Weg gefunden, Gold-Nanocluster nicht nur als wirksame antimikrobielle Wirkstoffe zu verwenden, sondern auch als Mechanismus zur Erhöhung der Wirksamkeit von Antibiotika, die aufgrund der Arzneimittelresistenz von Bakterien wirkungslos geworden sind.“ sagen Dejian Zhou, ein Chemieingenieur aus Leeds.
„Die Forschung ist in Bezug auf die Art und Weise, wie wir über die Reaktion auf antimikrobielle Resistenzen nachdenken sollten, von Bedeutung.“
Die zunehmende Antibiotikaresistenz ist eines der dringendsten Probleme der modernen Medizin und droht, einige unserer wertvollsten Abwehrmaßnahmen gegen Infektionen nutzlos zu machen.
Es ist gut und schön, neue Wege zu finden, Bakterien abzutöten. Aber es wäre auch eine große Erleichterung, Wege zu finden, unsere aktuelle Sammlung von Behandlungen zu erhalten.
Dies könnte buchstäblich eine einmalige Gelegenheit sein, uns eine zweite Chance zu geben, uns vor Krankheiten zu schützen, die im Laufe der Geschichte so viele Menschenleben gefordert haben.
Diese Studie wurde veröffentlicht in chemische Wissenschaften.